서 론
최근 선진국들을 중심으로 지구온난화를 완화시키기 위해 저탄소 에너지 공급원 개발에 많은 노력들을 기울이고 있으며, 탈탄소 에너지 연료로써 가장 고효율의 에너지를 생산할 수 있는 수소연료의 중요성은 날로 증가하고 있다(Murray et al., 2020; Boreham et al., 2021; Kim et al., 2021). 특히, 석탄연료 수입 의존성이 매우 높은 것으로 보고되고 있는 독일, 일본, 한국 등의 국가들은 주요 사용 연료를 수소에너지로 전환하는 것이 해당 국가들의 산업과 수송 분야에서 발생하는 탄소를 저감할 수 있는 것으로 평가된 바 있다(Boreham et al., 2021).
수소(H2)의 주요 공급원은 지구 대기층 최하부(대류권)에서 발생하는 메탄(CH4)의 광화학적 산화작용, 유기탄소 화합물로부터의 공급, 석탄연료의 열분해 과정에 의한 인위적인 공급 등이 있다(Ehhalt and Rohrer, 2009; Klein et al., 2020). 그 중 인위적인 공정과정을 통해 생산되는 수소는 그레이수소, 브라운수소, 그린수소 등으로 분류된다. Wood Mackenzie(2022)에 의하면 전세계 산업에서 에너지원으로 사용되는 수소는 대부분 생산과정에서 CO2를 발생시키는 그레이, 브라운, 블랙수소로 알려져 있다. 반면에 CO2 배출없이 수소를 생산하는 기술인 그린수소는 재생에너지(태양광에너지, 풍력에너지 등)를 연료로 사용하여 수전해 방식을 통해 수소를 생산하는 기술이지만, 에너지 생산 효율성의 한계점을 해결하지 못한 실정이다(Kim et al., 2021; Wood Mackenzie, 2022).
지질학적 요인에 의해 발생하는 비생물기원 수소(abiotic hydrogen)는 백색수소의 일종이며, 주요 산출지인 중앙해령의 열수벤트(hydrothermal vent)나 Chimaera gas seep과 같은 오피올라이트(ophiolite) 등에서 10% 이상의 높은 농도를 가지는 수소 가스 분출 양상이 보고된 바 있다(Fig. 1; Neal and Stranger, 1983; Angino et al., 1984; Moore and Sigler, 1987; Etiope et al., 2011; Morrill et al., 2013; Lollar et al., 2014; Deville and Prinzhofer, 2016).
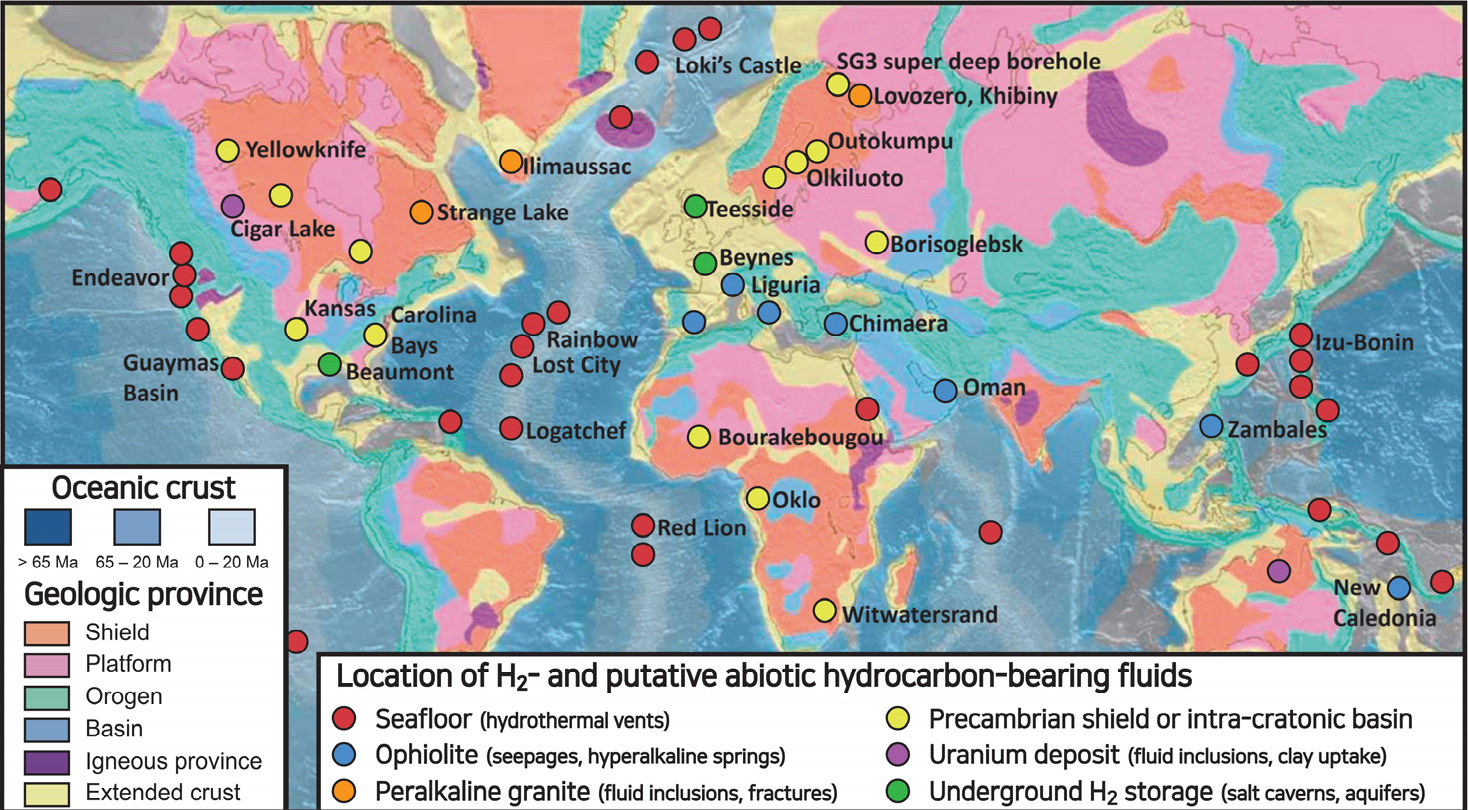
Fig. 1.
Map of well-documented occurrences of fluids enriched in H2 and abiotic hydrocarbons in various environments (modified from Truche et al., 2020).
이러한 지질환경에서 천연수소를 생산하는 주요 기작은 지하심부에서 발생하는 사문암화작용이다. 사문암화작용이란 500°C 이하의 온도와 다양한 압력 조건 하에서 고철질 또는 초고철질암석이 물과 반응하는 물-암석 반응(열수변질작용)으로 2차광물(사문석, 자철석 등)과 수소, 메탄, 이산화탄소 가스를 생성하는 것으로 알려져 있다(Charlou et al., 2002; Sleep and Bird, 2007; Flores et al., 2011; Mayhew et al., 2013; Murray et al., 2020; Truche et al., 2020, 2021; Boreham et al., 2021). Fig. 2와 같이 사문암화작용과 연관된 수소에 대한 연구는 1970년대부터 시작되어 2000년대를 기점으로 급격히 증가하였으나, 2010년 이전까지는 대부분의 연구가 해령이나 오피올라이트에서 발생하는 사문암 또는 유체의 기원지와 생성 환경 추적에 집중하였다(Magaritz and Taylor Jr, 1974; Wenner and Taylor Jr, 1974; Wenner, 1979; Blattner, 1985; Bowers, 1989; Kyser et al., 1999; Holm and Charlou, 2001; Schroeder et al., 2002; Bryanchaninova et al., 2004; Proskurowski et al., 2006; Des Marais, 2007; Marques et al., 2010).
그 중 일부 연구는 해령이나 오피올라이트에서의 사문암화작용을 통한 비생물기원 수소의 지질학적 생산 메커니즘을 규명하고자 하였다(Janecky and Seyfried, 1986; Berndt et al., 1996; Sleep et al., 2004; Bach et al., 2006; Jones et al., 2010; Lang et al., 2012; Frost et al., 2013; Mayhew et al., 2013; McCollom and Donaldson, 2016; Lazar, 2020; McCollom et al., 2020; Truche et al., 2020). 그러나 현재까지 보고된 연구들 중 실내실험 규모의 물-암석 반응 실험을 수행한 연구는 상대적으로 적은 편이며, 그 연구들의 결과를 바탕으로 지질학적 천연수소 생산성에 대해 정량적으로 비교하는 것은 각각의 실험 조건(온도, 압력, 반응광물, 유체 성분, pH, 물-암석 비 등)들이 상이하기 때문에 어려운 실정이다.
현재까지 보고된 물-암석 반응 실험을 수행한 연구들을 확인한 결과(Berndt et al., 1996; Jones et al., 2010; Mayhew et al., 2013; McCollom and Donaldson, 2016; Miller et al., 2017; McCollom et al., 2020; Truche et al., 2021), 비생물기원 수소의 생산량은 1차적으로 온도에 큰 영향을 받으며 2차적으로 다양한 조건(1차 광물 내 Fe2+ 함량, 유체 성분, 압력, pH, 1차 광물 입도 등)의 영향을 받는 것으로 알려져 있다. 따라서 본 리뷰에서는 물-암석 반응 실험을 수행한 해외연구 사례들을 저온 열수변질작용과 고온 열수변질작용으로 구분하여 연구 동향을 검토하였다. 또한 현재까지 보고된 연구들 중 실험에 있어 어떤 한계점이 있는지 살펴보고 향후 관련 연구가 보완해야하는 부분에 대하여 논의하였다.
저온 열수변질작용(100°C 이하)
Mayhew et al.(2013)은 산 카를로스 감람암(San Carlos peridotite), 산 카를로스 감람석(San Carlos olivine), 철감람석(fayalite), 자철석(magnetite), 페테두나이트(petedunite), 헤덴버자이트(hedenbergite)의 H2 생산량을 비교하기위해 저온 물-암석 반응 실험을 진행하였다. 해당 연구의 저온 물-암석 반응 실험은 인공 해수 시료(0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4)를 제조하여 고체시료와 약 800시간(55°C) 또는 2,400시간(100°C) 동안 진행되었다.
일반적으로 Fig. 3e와 3d처럼 Fe2+ 함량이 높은 철감람석(1.84 mol Fe pfu)이 Fe2+ 함량이 적은 감람석(0.2 mol Fe pfu)에 비해 더 많은 H2를 생산한다. 하지만, 이 결과와는 반대로 Fe2+ 함량이 적은 광물이 Fe2+ 함량이 많은 광물보다 더 많은 H2를 생산하기도 하였다. 예를 들어, 페테두나이트(0.3 mol Fe pfu)의 최대 H2 생산량은 약 280 nmol/kgrock이며, 페테두나이트보다 많은 Fe2+를 함유하는 헤덴버자이트(0.8 mol Fe pfu)는 약 90 nmol/kgrock 정도로 훨씬 적은 양의 H2를 생산하였다(Fig. 3b, 3d). 해당 연구에서는 광물 내 Fe2+ 함량, 온도, 광물의 비표면적과 H2 생산량 간 상관관계를 규명하려 하였으나, 유의미한 상관관계를 찾지 못하였다. 이러한 현상의 원인은 실험에 사용된 전암시료 내 스피넬 입자 표면의 전자가 물분자 혹은 양성자에 흡착되어 H2 생산량에 주요한 영향을 끼친 것으로 해석하였으며(Fig. 4), 본 연구의 물-암석 반응 실험을 통해 생성된 H2의 양은 1차 광물시료 내 스피넬 함량과 유의미한 상관관계(R2 = 0.97, p < 0.05)를 가지는 것을 확인하였다. 하지만, 열수변질작용에 의한 H2 생산량 차이에 대한 스피넬의 촉매작용의 증거는 해당 연구에서 명확하게 제시되지 않았다. 이는 실험 과정에서 발생하는 광물의 화학적 조성 변화를 실시간으로 관찰하기 힘들며, 실험 진행 중 고체 또는 액체시료를 채취하여 분석할 경우 설정한 실험 조건들이 변경되기 때문인 것으로 판단된다.

Fig. 3.
Production of H2 during water-rock reactions at 55°C (dashed lines) and 100°C (solid lines). All experiments were conducted in triplicate (modified from Mayhew et al., 2013).

Fig. 4.
Mechanism of H2 generation promoted on a spinel surface. (a) Dissolved Fe2+-bearing silicates lead to the release of Fe2+ and aqueous silica into the solution. Fe2+ adsorbed on the spinel surfaces participates in interfacial electron transfer, resulting in the continuous reduction of water and/or protons. (b) Localized precipitation of the secondary phase on surface layers may halt H2 generation because of the release of Fe2+ from the primary minerals and/or oxidation of Fe2+ in the spinel surface. Adsorbed Fe2+ produces a Fe3+-(hydr)oxide on the surface layer of adjacent spinel (modified from Mayhew et al., 2013).
Miller et al.(2017)은 사말리 오피올라이트(Samali ophiolite)에서 채취한 오만 두나이트(Oman dunite)의 저온 열수변질작용에 의해 생산되는 H2 생산량을 정량적으로 평가하기 위해 실내실험 규모의 물-암석 반응 실험을 수행하였다. 실험 진행 전 고체시료의 광물 함량을 파악하기 위해 XRD(X-ray diffraction) 분석을 수행하였고, 반응 전 오만 두나이트는 감람석(olivine, 51%), 리자다이트(lizardite, 43%), 수활석(brucite, 6%)으로 구성된 것이 확인되었다(Fig. 5).

Fig. 5.
Powder XRD of Oman dunite reacted with SW and RW. Unreacted rock (red solid line) contains lizardite (green dashed line), forsterite (purple dashed line), and brucite (black dashed line). Rock specimens reacted with SW (blue) and RW (orange) contain lizardite and forsterite but not brucite (modified from Miller et al., 2017).
반응 유체는 인공 염수 시료인 seawater(SW)와 rainwater(RW)를 제조하여 실험에 사용하였다. SW는 NaCl(27.5 g/L), CaCl2(1.4 g/L), KCl(0.72 g/L), NaHCO3(0.2 g/L), NH4Cl(1.0 g/L), K2HPO4(0.05 g/L), MgCl2(5.38 g/L)를 이용하여 제조하였으며, RW는 NaCl(9.89 mg/L), CaCl2(11.10 mg/L), KNO3(5.06 mg/L), Ca(OH)2(7.41 mg/L), CaSO4 ‧ H2O(30.83 mg/L), Mg(SO4)2 ‧ 7H2O(12.32 mg/L)로 제조하였다. 실험에 사용된 오만 두나이트(5 g)는 35 mL의 유체(SW, RW)와 각각 혼합하여 100°C에서 반응시킨 후, 액상 시료와 기체상 시료를 모두 채취하고 gas chromatography(GC)와 liquid chromatography(LC)를 통해 생산된 H2양을 측정한 뒤 합산하였다. SW를 이용한 물-암석 반응 실험은 203일, RW를 이용한 물-암석 반응 실험은 97일 동안 진행하였다. SW의 열수변질작용에 의해 생산되는 H2의 양은 반응 시작 후 92일까지 지속적인 증가추세를 보이고 그 후 감소하였으며, 반응 시작 후 92일 후에 측정한 H2 농도는 470 nmol/gmineral로 측정되었다(Fig. 6). RW는 반응 시작 후 37일까지 지속적인 H2 농도의 증가 추세(최대 H2 농도: 280 nmol/gmineral)를 보였으나 37일 이후에는 감소하는 경향을 보였다.

Fig. 6.
Production of H2 during reactions of Oman dunite with SW (blue solid lines) and RW (red dashed lines). All experiments were conducted in triplicate (modified from Miller et al., 2017).
또한 물-암석 반응 실험 시작 후, RW의 양이온(Mg2+, Fe2+, Mn2+) 농도는 실험 시작 후 24시간까지 급격한 증가 추세를 보였으나, 24시간이 지난 후 급격하게 감소하였다(Fig. 7a, 7b). 이는 실험이 시작된 후 일차적으로 수활석의 용해가 진행되어 용존 양이온의 농도가 증가하였고, 24시간이 지난 시점부터는 용존 양이온들이 자철석, 사문석 등의 2차광물의 결정화작용에 관여하여 급격한 농도 감소를 보였기 때문으로 해석된다. RW의 pH는 실험 시작 후 24시간까지 양이온의 용출과 함께 급격한 증가 추세를 보이다가 24시간 이후부터는 일정한 범위를 유지하는 것으로 나타난다(Fig. 8). 본 연구에서 관찰된 pH의 급격한 증가 추세는 수활석의 용해에 의해 발생한 것으로 해석된다. SiO2 농도는 경우, 다른 양이온들과는 달리 서서히 증가하였으나, 암석 시료 내 규산염 성분의 용해에 대한 흔적은 발견하지 못하였다.

Fig. 7.
Water chemistry of the RW solution reacting with Oman dunite over 50 days. The initial release of cations (Mg2+, Fe2+, and Mn2+) resulted in their maximum concentrations after 24 h of water-rock reaction. The cation concentrations in the solution then gradually decreased over time. The concentration of SiO2(aq) in the solution slowly increased during the reaction (modified from Miller et al., 2017).

Fig. 8.
pH changes in the RW solution during water-rock reaction. The pH initially increased to 9 in the first 24 hours, then slowly declined (modified from Miller et al., 2017).
해당 연구에서 사용된 유체시료 중 SW는 RW보다 상대적으로 더 많은 H2를 생산하였다. 이는 SW가 RW와 달리 인산염, 중탄산염을 상대적으로 많이 함유하여 수활석의 용해가 촉진되었기 때문으로 해석된다. Pokrovsky et al.(2005)에 따르면 인산염, 중탄산염 등의 무기질 리간드(inorganic ligand)가 광물 입자 표면의 metal-oxygen bond를 끊고 광물의 용해를 촉진시키는 것으로 보고한 바 있다.
Miller et al.(2017)의 두나이트와 해수의 물-암석 반응 실험에 의한 H2 생산성은 Mayhew et al.(2013)의 광물별 H2 생산성에 비해 최대 약 400 nmol/gmineral 더 높은 것으로 확인되었다(Table 1). 하지만 이 결과를 토대로 Miller et al.(2017)에서 사용된 두나이트 시료가 Mayhew et al.(2013)에서 사용된 헤덴버자이트, 자철석, 감람암 등의 전암시료보다 더 많은 H2 생산성을 가진다고 판단하기는 어려움이 있다. 그 이유는 Mayhew et al.(2013)과 Miller et al.(2017)의 물-암석 반응 실험 모두 실험 종료 시점에서 H2 생산이 종료되지 않고 지속적으로 생산되고 있으며, 물-암석 반응 실험에 사용된 고체 시료의 비표면적도 모두 상이하기 때문이다.
Table 1.
Comparison of experimental conditions and hydrogen production in previous lab-scale experiments (T = 100°C)
| Sample |
H2 (nmol/ kg) |
T (°C) |
Water- rock ratio | pH | Solution |
Time (h) |
Grain size (µm) |
Specific surface area (m2/g) | Ref. |
| Dunite | 280 | 100 | 7:1 | 9 |
NaCl (9.89 mg/L), CaCl2 (11.10 mg/L), KNO3 (5.06 mg/L), Ca(OH)2 (7.41 mg/L), CaSO4 ‧ H2O (30.83 mg/L), Mg(SO4)2 ‧ 7H2O (12.32 mg/L) | 882 | 53~212 | 0.47~0.60 | Miller et al. (2017) |
| Dunite | 480 | 100 | 7:1 | 9 |
NaCl (27.5 g/L), CaCl2 (1.4 g/L), KCl (0.72 g/L), NaHCO3 (0.2 g/L), NH4Cl (1.0 g/L), K2HPO4 (0.05 g/L), MgCl2 (5.38 g/L) | 2,190 | 53~212 | 0.47~0.60 | |
| Fayalite | 170 | 100 | 7:1 | <7 |
0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4 | 1,206 | 53~212 | 0.2506 | Mayhew et al. (2013) |
|
Heden- burgite | 92 | 100 | 7:1 | <7 |
0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4 | 2,331 | 53~212 | 6.9959 | |
| Magnetite | 180 | 100 | 7:1 | <7 |
0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4 | 114 | 53~212 | 0.5738 | |
| Olivine | 120 | 100 | 7:1 | <7 |
0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4 | 2,339 | 53~212 | 0.2728 | |
| Peridotite | 300 | 100 | 7:1 | <7 |
0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4 | 1,213 | 53~212 | 0.3442 | |
| Petedunite | 280 | 100 | 7:1 | <7 |
0.5 M NaCl, 30 mM MgCl2, 1 mM CaCl2, 14 mM KCl, 2 mM NaHCO3, 2 mM NH4Cl, 30 µM K2HPO4 | 334 | 53~212 | 0.2806 |
고온 열수변질작용(100°C 이상)
Berndt et al.(1996)은 300°C/500 bar 조건에서 감람석의 사문암화작용이 진행될 때 생성되는 수소와 탄화수소 가스의 생산량을 파악하고자 실내실험 규모의 물-암석 반응 실험을 수행하였다. 해당 연구에서는 고체시료로 감람석(Fo88), 액체시료는 CO2 함유 NaCl 유체(0.5 mol/kg NaCl, 8.9 mmol/kg NaHCO3)를 선정하여 1,658시간 동안 물-암석 반응 실험을 진행하였다. 실험 시작 후 48시간이 지난 시점에서 약 11.5 mmol/kg의 H2가 생산되었으며, 674시간까지 급격한 H2 생산량의 증가 추세가 관찰되었다. 674시간 이후부터는 H2 생산량의 증가추세가 다소 감소하였으며, 실험이 종료된 시점(1,658시간)에서의 H2 생산량은 약 158 mmol/kg으로 측정되었다(Fig. 9).
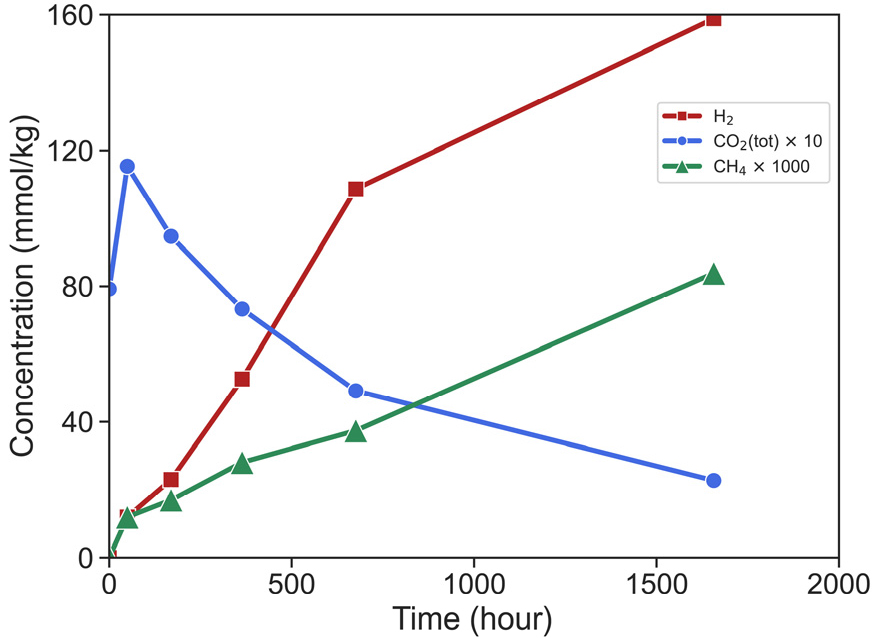
Fig. 9.
Gas (H2, CO2, and CH4) generation during experimental serpentinization of olivine at 300°C and 500 bar (modified from Berndt et al., 1996).
물-암석 반응 실험에 의해 생성된 가스 시료의 산소 퓨가시티(Log fO2)와 이산화탄소 퓨가시티(Log fCO2)를 도시한 결과, 모든 가스 시료가 자철석과 수활석이 안정한 영역에 분포하였다(Fig. 10). 일반적으로 FeO-H2O-O2-CO2 계에서 Fe2+를 함유한 광물 중 자철석과 수활석을 제외한 FeO(뷔스타이트, wüstite) 또는 FeCO3(능철석, siderite)는 자철석에 비해 준안정적인 상태로 존재하기 때문에 사문암화작용이 진행될 때 주로 자철석이 침전되는 것으로 알려져 있다(Frost, 1985). 또한 해당 연구에서의 물-암석 반응 실험이 종료된 후 암석 시료 내 대량의 자철석이 존재하는 것이 확인됨에 따라 본 실험을 통해 생성된 H2는 감람석 시료의 산화작용과 자철석의 침전으로 인해 생성된 것으로 해석할 수 있다.

Fig. 10.
LogfCO2-LogfO2 diagram for the system FeO-H2O-O2-CO2 at 300°C and 500 bar with fluid chemistry. Numbered points represent the sample number. The dashed line (CO2/CH4) shows where the CO2 and CH4 fugacity would be equal when in equilibrium. All of the results after the water-rock interaction lie within the methane stability region and the graphite field, indicating a thermodynamic process for methanization and graphitization of CO2 (modified from Berndt et al., 1996).
McCollom et al.(2020)은 230°C/350 bar 조건에서 감람석과 사방휘석을 혼합한 고체시료(OlivOpx230)와 유체(485 mmol NaCl/kg + 19.4 mmol NaHCO3/kg)의 열수변질작용에 의한 H2 생산량을 규명하기 위해 약 9,300시간 동안 물-암석 반응 실험을 수행하였다. 또한, 물-암석 반응 실험 결과와 비교하기 위하여 EQ3/6(버전 7.2b) 소프트웨어를 활용한 반응 경로 모델(reaction path model)을 사용하였다. 물-암석 반응 실험 결과, 약 2,000시간까지는 H2 생산량이 거의 없는 것으로 확인되었다(Fig. 11). 실험 시작 후 2,000시간부터 3,000시간까지는 상대적으로 눈에 띄는 H2 생산량의 증가 추세가 확인되었으며, 3,000시간이 지난 시점에서의 H2 생산량은 약 3.3 mmol/kgmineral로 측정되었다. 약 4,000시간이 지난 시점부터는 급격한 H2 생산량의 증가 추세가 확인되었으며, 실험이 종료된 시점(약 9,300시간)에서 생산된 H2 농도는 약 90 mmol/kgmineral로 나타났다.
해당연구에서 수행된 반응 경로 모델은 실험 종료 시간을 정확히 설정할 수 없기 때문에 반응 진행율을 0~100%로 설정하였다. 반응 경로 모델링 결과, 반응 초기에는 1차 광물(감람석, 사방휘석)의 용해와 2차 광물(활석과 사문석)의 침전이 진행되었으며, 활석은 모두 재용해되어 사라지게 된다(Fig. 12). 이후 자철석의 침전이 시작되었으나, 사방휘석이 완전히 용해된 후부터 자철석의 침전은 중단되어 일정한 양을 유지하게 되고 연속적으로 수활석이 침전되기 시작한다.
물-암석 반응 실험과 모델링 결과를 종합적으로 해석하면 해당 연구에서 진행된 물-암석 반응은 총 3단계로 구분될 수 있다(Fig. 11). 1단계(약 2,000시간 이전)는 약 -2.5에서 -3.5의 실리카 액티비티가 측정되는 구간이며, 활석과 사문석이 평형상태에 존재하는 범위로 H2 생산량은 거의 없는 것으로 확인되었다. 2단계(2,000~4,000시간)는 1단계 이후 실리카 액티비티의 지속적인 감소가 발생하는 구간으로 사문석만 침전된다. 이 구간에서는 1단계에 비해 상대적으로 눈에 띄는 H2 생산량의 증가를 확인할 수 있었다. 3단계에서 실리카 액티비티의 변화는 거의 관찰되지 않으며, 자철석의 침전은 중단되고 수활석의 침전이 시작됨과 동시에 H2 생산량이 급격하게 증가하게 된다. 물-암석 반응 실험이 종료된 시점(3단계 종료)에서 반응셀 내부에는 극소량의 수활석이 존재하였으며, 반응 경로 모델링 결과와의 비교를 통해 해당 연구에서의 물-암석 반응은 전체 반응 진행율 중 약 50% 이내로 진행된 것을 알 수 있었다.

Fig. 11.
Production of H2 and silica activityin situ [aSiO2(aq)] during experimental serpentinization of OlivOpx230. Gray dashed lines represent silica activities for the stable equilibrium of talc/serpentine, serpentine/brucite, and olivine/brucite (modified by McCollom et al., 2020).

Fig. 12.
Simulation of mineral composition changes during experimental serpentinization of OlivOpx230 at 230°C by the reaction path model. The dashed line represents the degree of reaction progress at the end of the experimental serpentinization (modified from McCollom et al., 2020).
본 선행 연구는 사문암화작용을 통해 H2를 생산하는 과정에서 발생하는 광물 ‧ 화학적 변화 결과를 보여주는 매우 의미있는 연구이다. 또한, Fig. 12에서 확인할 수 있듯이 실제 실험 종료 시점인 9,300시간에서의 생산된 H2 농도는 약 90 mmol/kgmineral로 더 오랜 기간동안 실험이 진행되었다면 추가적인 H2 생산량을 전망할 수 있는 결과이다. 하지만 해당 연구에서 사용된 반응 경로 모델이 실제 실험 과정에서 발생하는 화학반응들을 모두 반영하지 못하였다는 한계점은 존재하였다. 예를 들어, H2 생산량에 대한 모델링 결과는 측정값보다 약 1.6배의 높게 나타나는 것으로 확인되었으며(Fig. 13a), 이 결과는 모델링을 통해 계산된 사문석의 Fe3+/Fetotal 비가 측정값에 비해 높게 계산되었기 때문인 것으로 나타났다(Fig. 13b).

Fig. 13.
Simulated results of experimental serpentinization by the reaction path model and measured data of experiment OlivOpx230 at 230°C. (a) Predicted (red dashed line) and measured (red triangles) pHin situ and predicted (blue solid line) and measured (blue circles) H2 generation. (b) Predicted (solid lines) and measured (symbols) data of Mg# from chrysotile (green), Mg# from brucite (red), and the Fe3+:Fetotal ratio of chrysotile (purple) (modified from McCollom et al., 2020).
Truche et al.(2021)은 캐나다 Strange Lake 일대에 분포하는 과알칼리 화강암(peralkaline granite)의 열수변질작용에 의한 H2 생산량을 다양한 조건(전암시료: 과알칼리 화강암, 단일광물 시료: 아르베존섬석(arfvedsonite), 유체의 pH와 염도)에서 비교하기 위해 실내실험 규모의 물-암석 반응 실험을 수행하였다. 반응 유체는 4 종류의 유체((1) H2O, (2) 3 m NaCl + 0.1 m HCl, (3) 3 m NaCl, (4) 3 m NaCl + 0.1 m NaOH)를 실험에 사용하여 pH와 염도를 조정하였으며, 물-암석 반응 실험의 온도-압력 조건은 350°C와 500 bar로 설정하여 총 15일(360시간)동안 실험을 진행하였다. 실험결과, pH에 따른 H2 농도는 중성, 염기성, 산성 순으로 높게 나타났으며, 염도가 상대적으로 낮을 때 더 많은 H2를 생산하였다(Fig. 14). 전암시료와 단일광물의 H2 생산량을 비교한 결과, 대부분의 실험에서 화강암 전암시료의 열수변질작용에 의한 H2 생산량((1) H2O: 26-35 mmol/kgrock, (2) 3 m NaCl + 0.1 m HCl: 3 mmol/kgrock, (3) 3 m NaCl: 19 mmol/kgrock, (4) 3 m NaCl + 0.1 m NaOH: 9 mmol/kgrock)은 단일광물 시료인 아르베존섬석((1) H2O: 12-15 mmol/kgrock, (2) 3 m NaCl + 0.1 m HCl: 1 mmol/kgrock, (3) 3 m NaCl: 8 mmol/kgrock, (4) 3 m NaCl + 0.1 m NaOH: 11 mmol/kgrock)에 비해 상대적으로 더 많은 것을 확인할 수 있었다(Fig. 14). 이는 화강암 전암시료의 철 성분이 대부분 아르베존섬석으로부터 기인한 것을 고려한다면 전암시료와 단일광물 시료의 H2 생산량은 거의 유사할 것이라는 예측과는 달리 전암시료의 H2 생산량이 단일광물에 비해 약 2배 이상 많다는 결과를 나타낸다.

Fig. 14.
H2 generation after hydrothermal alteration at 350°C and 500 bar for 360 h. Experiments used different initial fluid compositions to evaluate the effect of pH and salinity. Production of H2 normalized to the mass of solids (SL-granite or arfvedsonite) as a function of fluid composition (modified from Truche et al., 2021).
본 선행연구의 저자는 과알칼리 화강암 전암시료와 아르베존섬석 단일 광물시료에서 발생하는 H2 생산량 차이를 설명하기 위해 두 가지 가설을 제시하였다. 첫 번째는 과알칼리 화강암 내 아르베존섬석을 제외한 다른 철 함유 광물의 개입이다. 본 연구에서 사용된 과알칼리 화강암 내 철 함유 광물은 아르베존섬석과 알칼리 장석이다. 하지만 알칼리 장석의 경우 극소량의 Fe3+(0.23 wt% Fe2O3, Siegel et al., 2018)을 가지고 있기 때문에 철 성분의 산화작용을 통해 H2가 생산될 수 없다. 두 번째 가설은 열수변질작용에 의해 반응셀 내부 환경이 알칼리 환경으로 전환되는 것이다. 열수변질작용으로 인해 발생한 알칼리 환경은 자철석이나 층상규산염광물과 같은 2차 광물의 침전을 촉진시키기 때문에 H2가 많이 생산된 것으로 추측할 수 있다. 이를 뒷받침하는 근거로 과알칼리 화강암 시료의 물-암석 반응 실험 종료 후 자철석과 층상 규산염광물이 아르베존섬석의 물-암석 반응 실험보다 많이 침전된 것을 확인하였다. 따라서, 열수변질작용에 의해 생산되는 H2는 상기한 두 번째 가설에 의해 촉진되는 것으로 보고하였다.
Truche et al.(2021)에서 보고한 과알칼리 화강암 전암시료의 H2 생산량(26~35 mmol/kgrock)은 McCollom et al.(2020)과 Berndt et al.(1996)에 의해 보고된 H2 생산량에 비해 2배 이상 적은 것으로 확인되었다(Table 2). 하지만 Truche et al.(2021)의 실험 기간(360시간)이 McCollom et al.(2020)과 Berndt et al.(1996)의 실험 기간에 비해 약 5~26배 짧은 것을 감안한다면 Truche et al.(2021)의 연구에서 사용된 과알칼리 화강암은 H2 생산에 대해 월등한 잠재성을 지니는 것으로 평가할 수 있다. 또한, 기존 선행연구들이 감람석 또는 휘석 등 해령이나 오피올라이트에서 주로 산출되는 감람석의 사문암화작용에 집중하여 물-암석 반응 실험을 진행한 것과는 달리, Truche et al.(2021)은 물-암석 반응 실험을 통해 과알칼리 화강암의 H2 생산 가능성을 제시하였다. 이는 현재까지 보고된 선행연구들과는 달리 Fe2+를 함유하는 다양한 암종 및 광물들의 높은 H2 생산성을 전망할 수 있는 결과로, 추후 국내 비생물기원 천연수소 생산 가능성 평가를 위해 국내에 분포하는 Fe2+를 함유하는 다양한 암석을 대상으로 물-암석 반응 연구들의 필요성을 시사한다.
Table 2.
Comparison of maximum hydrogen production in previous lab-scale experiments (T > 100°C)
| Sample |
H2 (mmol/kg) |
T (°C) |
Pressure (bar) |
Water- rock ratio | pH | Solution |
Time (h) |
Grain size (µm) | Ref. |
| Olivine | 158 | 300 | 500 | 2.25 | <7.69 |
0.5 mol NaCl/kg + 8.9 mmol NaHCO3/kg | 1,658 | <75 | Berndt et al. (1996) |
|
Olivine + Orthopyroxene | 61 | 230 | 350 | 1.8 | <7.2 |
485 mmol NaCl/kg + 19.4 mmol NaHCO3/kg | 9,287 | 53-212 | McCollom et al. (2020) |
|
Peralkaline granite | 36 | 350 | 500 | 1 | 9.5 | H2O | 360 | 53-212 | Truche et al. (2021) |
|
Peralkaline granite | 3 | 350 | 500 | 1 | 1 | 3 m NaCl + 0.1 m HCl | 360 | 53-212 | |
|
Peralkaline granite | 19 | 350 | 500 | 1 | 9.5 | 3 m NaCl | 360 | 53-212 | |
|
Peralkaline granite | 9 | 350 | 500 | 1 | 13 | 3 m NaCl + 0.1 m NaOH | 360 | 53-212 | |
| Arfvedsonite | 16 | 350 | 500 | 1 | 9.5 | H2O | 360 | 53-212 | |
| Arfvedsonite | 1 | 350 | 500 | 1 | 1 | 3 m NaCl + 0.1 m HCl | 360 | 53-212 | |
| Arfvedsonite | 7 | 350 | 500 | 1 | 9.5 | 3 m NaCl | 360 | 53-212 | |
| Arfvedsonite | 11.5 | 350 | 500 | 1 | 13 | 3 m NaCl + 0.1 m NaOH | 360 | 53-212 |
결 론
본 리뷰에서는 비생물기원 수소 생산을 위해 물-암석 반응 실험을 진행한 해외 연구 사례들을 저온 열수변질작용과 고온 열수변질작용으로 구분하여 각 실험에서 보고된 결과, 해석, 한계점에 대해 논의하였다. 이번 리뷰에서 활용된 선행 연구들의 실험들은 물-암석 반응 실험에 사용된 유체의 특성, 암석 혹은 광물 시료의 크기, 반응시간, 온도, 압력 등의 조건들이 매우 상이한 것으로 확인되었다. 또한 대부분의 실험들이 수 일부터 수 개월 동안 물-암석 반응 실험을 진행했음에도 불구하고 수소 생산이 종료되는 시점까지 도달하지 못하였다. 이러한 이유들로 인해 선행 연구들의 물-암석 반응 실험 결과를 바탕으로 비생물기원 수소 생산성을 정량적으로 비교 분석하는 것은 어려울 것으로 판단된다.
해외의 경우, 비생물기원 수소 생산을 위해 물-암석 반응 실험 연구 외에도 연구 지역에 대한 암석 ‧ 광물학적 연구를 통해 높은 농도의 수소를 가지는 유체포유물을 발견하거나, 단열 또는 절리 내에서 발견된 가스 중 높은 농도의 수소를 관찰하는 등 연구 지역 내 수소 부존 가능성을 인지할 수 있는 지질학 분야의 선행 연구가 보고된 바 있다. 반면에, 국내의 경우 현재까지 보고된 선행 연구들 중 지질학적으로 수소 부존 가능성을 가늠할 수 있는 단서를 제공한 연구는 거의 없으며, 비생물기원 수소 생산 관련 연구에 대한 관심 또한 부족하기 때문에 현 시점에서 국내 비생물기원 수소 생산 가능성을 평가하는 것은 매우 힘든 실정이다. 따라서, 향후 국내 비생물기원 수소 생산 가능성 평가를 위해서는 다음과 같은 연구들이 필수적으로 진행되어야 한다. 먼저 실내실험으로는 국내에 분포하는 고철질 암석 또는 Fe2+ 함유 광물들을 대상으로 국내 지질환경을 반영한 물-암석 반응 실험이 수행되어야 하며, 다양한 지질학적 조건에 따른 수소 생산성 평가를 위해 물-암석 반응 실험의 조작변인, 종속변인, 통제변인을 명확히 설정한 실험 설계가 동반되어야 한다. 현장 조사 측면에서는 연구지역 선정을 위한 물리탐사 또는 원격탐사 연구, 연구지역 내 암석들의 특성을 파악하기 위한 암석학 ‧ 광물학적 연구, 연구지역 내 단층과 절리 등의 분포를 파악할 수 있는 구조지질학적 연구, 연구지역 내 지하유체 특성을 파악하기 위한 수리지질학적 연구 등 다양한 분야에서 연구가 병행되어야 할 것으로 판단된다.





